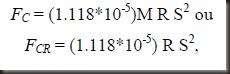Início » Posts etiquetados como 'Física Aplicada'
Arquivo da tag: Física Aplicada
Física Aplicada – Centrifugação
Disciplina – Física Aplicada
Prof. Luiz Carlos M. Neves
Assunto: Centrifugação
1. Introdução.
A centrifugação é uma operação unitária amplamente utilizada nas áreas industriais e em bioquímica, biotecnologia, biologia celular, molecular, com a principal finalidade de separação de frações ou a concentração das moléculas de interesse. Pode ser realizada com o objetivo de separar sólidos de líquidos ou mesmo uma mistura de líquidos.
Uma partícula em movimento linear continuará em velocidade constante e uniforme se não for influenciada por forças externas.
Quando uma partícula é submetida a uma força centrífuga (g) para isolar partículas suspensas em seu meio, seja da forma em lotes ou fluxo contínuo, esta sedimentação é forçada. As aplicações de centrifugação são muitas e incluem testes de análises clínicas, testes bioquímicos, a sedimentação de células e vírus, a separação de massa celular, isolamento de DNA, RNA, proteínas ou lipídios ou até mesmo para secar a roupa ou a salada em casa (Figura 1).
2. Aumento no efeito da gravidade: a centrífuga.
Se uma suspensão for deixada em repouso, as partículas dispersas irão se assentar por meio do fenômeno de decantação ou sedimentação, por ação da gravidade (g = 9,8 cm/s2). Primeiro serão sedimentadas as partículas maiores e depois as menores em valores de tempo variáveis, o que dificulta determinar o término da operação. Através da centrifugação este tempo é acelerado, pois pequenas partículas podem ser separadas com a aplicação da força centrífuga. Se compararmos com a filtração, a centrifugação é mais cara, porém a principal desvantagem da filtração é a possibilidade rápida de entupimento dos filtros, dependendo do tipo de material utilizado.
Quando uma suspensão de partículas é centrifugada a sedimentação das partículas é proporcional à força aplicada. As propriedades da solução também irão interferir na taxa de sedimentação.
3. O que é a força centrífuga?
Qualquer corpo ou partícula que apresente um movimento circular uniforme está submetido a uma força centrífuga, que tem como referência, o centro da trajetória circular que a partícula descreve, e pode ser representada pela relação:
![]() onde:
onde:
m = massa do corpo;
ω = velocidade angular do movimento de rotação e,
r = raio de rotação
Quanto maior for o número de rotações por segundo, maior será a força centrífuga aplicada na partícula e, quanto maior o raio da circunferência, maior a força centrífuga. A força centrífuga relativa (FCR) pode ser calculada por:
Onde:
R = raio de centrifugação, em m ou cm,
N = velocidade de centrifugação em rotações por minuto (rpm).
Quando uma suspensão é submetida a uma velocidade ou a um número de revoluções por minuto (RPM), a força centrífuga faz com que as partículas se afastem radialmente do eixo da rotação. A força aplicada nas partículas é chamada de Força Centrífuga Relativa (RCF). Por exemplo, um RCF de 500g indica que a força centrífuga aplicada é 500 vezes maior que a força gravitacional da Terra.
Quando se pretende separar componentes biológicos ou realizar a purificação de proteínas de interesse industrial, a operação unitária de centrifugação é bastante utilizada, podendo ser combinada com outras técnicas, dependendo da necessidade do produto. A centrifugação separa partículas por diferencial de tamanho ou densidade, enquanto que a eletroforese separa as partículas baseadas na carga elétrica; a cromatografia por solubilidade, dimensão, carga elétrica e a partição pela solubilidade do produto de interesse.
4. Tipos de rotores para centrífugas
Os rotores de centrífugas podem ser classificados como rotores móveis (1), de ângulo fixo (2) e vertical (3), sendo que cada tipo tem potências e limitações de acordo com o tipo de separação (Figura 3).
Os rotores verticais são adequados para separações isopícnicas (de densidade), como por exemplo para isolamento de DNA, RNA e lipoproteínas. Utilizam-se tubos graduados e é bastante utilizado para a determinação de volume de sedimentos. A principal desvantagem deste tipo de rotor é a ocorrência de sedimentação incompleta, pois a partícula tem que atravessar toda a “coluna” de líquido para chegar ao fundo do tubo. Para corrigir eventuais erros, utiliza-se uma rotação maior.
Em rotores de ângulo fixo, os tubos são posicionados em um ângulo definido. Ao iniciar a operação, o material se reorienta no interior do tubo, conforme a força centrífuga que é aplicada. Mais eficiente do que a centrifugação vertical, pois o caminho percorrido pela partícula é menor, é bastante utilizada em laboratórios de biotecnologia para separação de bactérias e leveduras. Este tipo de centrifugação em geral utiliza menor tempo e é eficiente para a separação de sólidos floculentos ou finamente divididos. Como principal desvantagem em relação à centrifugação vertical é não conseguir realizar a análise de volume de sedimento.
Os tubos de amostra quando inseridos em rotores móveis (1) são mantidos na vertical enquanto o equipamento está em repouso. Ao girar, se posiciona horizontalmente, dependendo da rotação que é aplicada.
Fatores para seleção de material de tubos para centrífuga: em escala laboratorial, os tubos devem ser transparentes, resistentes a solventes químicos e com boa vedação, compatibilidade química e boa recuperação da amostra.
Todo material fluido tende a expansão, gerando uma pressão sobre os tubos. Esta força (P) será somada à força centrífuga e, a somatória pode romper tubos. Atualmente, máquinas modernas possuem sistemas de proteção.
4. Tipos de Centrífuga.
 (a) Centrífuga tubular. Esta centrífuga opera geralmente na vertical, com o rotor tubular provendo um longo caminho para a separação da mistura. Trabalha com a força centrífuga variando de 13.000 a 20.000 g. A quantidade de sólidos na mistura limita o uso desta centrífuga, assim como a formação de bolhas que também dificulta a centrifugação.
(a) Centrífuga tubular. Esta centrífuga opera geralmente na vertical, com o rotor tubular provendo um longo caminho para a separação da mistura. Trabalha com a força centrífuga variando de 13.000 a 20.000 g. A quantidade de sólidos na mistura limita o uso desta centrífuga, assim como a formação de bolhas que também dificulta a centrifugação.
O material a ser centrifugado é alimentado pela parte inferior, e passa por toda a tubulação para ser separado ou clarificado. A parte sólida vai depositando-se nas laterais, sendo retirada ao final do processo, enquanto os líquidos são retirados pela parte superior.
Na indústria de alimentos é utilizada para a separação e clarificação de extratos animais
e vegetais e óleo de peixe. Na indústria farmacêutica é amplamente utilizada para a
recuperação de bactérias e frações de células.
(b) Centrífuga de múltiplos discos. A câmara possui uma série de discos paralelos que
proporcionam uma grande área de sedimentação. O material é removido através de válvulas.
Em casos de clarificação de material biológico, pode-se trabalhar com a força centrífuga
variando de 5.000 a 15.000g, sendo o fluxo contínuo de alimentação de 200 m3/h.
O tamanho da partícula pode auxiliar a centrifugação. Para aumentar o tamanho da
partícula, utiliza-se o fenômeno de coagulação ou floculação. Para coagulação, realiza-se a mudança de pH da suspensão, removendo as cargas eletrostáticas da partícula e então elas aproximam-se umas às outras. Para floculação, adicionam-se pequenas quantidades de materiais de alto peso molecular, carregadas com carga oposta ao do material, promovendo agregação dos componentes que podem estes baratos e efetivos, porém, sem afetar o produto de interesse. Para favorecer a coagulação são adicionados sais de alumínio, cálcio e ferro, além de polieletrólitos sintéticos que reduzem a repulsão entre as partículas e formam pontes entre elas.
(c) Centrífuga contínua opera horizontalmente A hélice roda e distribui os sólidos ao
longo da superfície do recipiente, retirando-o do líquido. O liquido sai pelo outro lado da câmara. O parafuso roda em velocidade diferente da câmara
(d) Centrífuga de Cestos
A centrífuga de cestos pode ser classificada como perfurada e não perfurada. A centrífuga perfurada associa as operações de centrifugação e filtração em conjunto, assemelhando-se ao tambor de uma máquina de lavar, por exemplo. Então, neste caso
especifico, pode-se considerar a centrifugação como uma operação de pré-secagem. No caso de sólidos cristalinos, utiliza-se o cesto sem filtros e no caso de partículas deformáveis, como por exemplo, proteínas.
No caso de cestos não perfurados, a ação é apenas da força centrífuga. As partículas sólidas tendem a se acumular nas paredes da centrífuga e, com o passar do tempo estas começam a ser liberadas junto com o filtrado.
Outras características também devem ser consideradas como, por exemplo, o uso de refrigeração no caso de tratamento de material biológico, centrífugas providas de aquecimento que alteram a viscosidade e a solubilidade do material.
5. Tipos de separação centrífuga.
A) Centrifugação diferencial
A separação é baseada no tamanho das partículas. Uma suspensão contendo diferentes moléculas é centrifugada e as partículas maiores sedimentam com mais rapidez do que as partículas menores, obtendo-se frações de moléculas.
Exemplo: quando uma suspensão de material biológico é deixado em repouso, as células intactas se depositam. Se centrifugados a 600g por 10 minutos, os núcleos densos sedimentam para o fundo do tubo. O sobrenadante é então centrifugado a 15.000g por 5 minutos para separar mitocôndrias e assim sucessivamente. Algumas destas organelas em sedimentação podem ser obtidas em pureza parcial, e em geral elas estão contaminadas com outras partículas, servindo como etapa preliminar para posterior purificação usando outros tipos de separação centrífuga.
B. Centrifugação por gradiente
A centrifugação diferencial não permite separar diferentes moléculas que se depositem em uma mesma etapa de centrifugação, embora possuam densidades diferentes. Para tanto, faz-se uso da centrifugação por gradiente, submetendo a suspensão de partículas a uma força centrífuga constante, em meio de densidade /peso gradualmente variável, de uma extremidade à outra do tubo. A fração celular a ser separada é colocada sobre a camada e centrifugada. Empregam-se substâncias como a sacarose. As partículas com densidades diferentes, se deslocam até alcançar o local de igual densidade. A separação por gradiente pode ser classificada em duas categorias: por índice regional (tamanho) e Separação isopícnica (densidade).
As frações isoladas podem, posteriormente, ser submetidas a uma gama diversificada de análises bioquímicas, para se identificar a composição química, a atividade enzimática, bem como as capacidades metabólicas.
– Separação gradiente de tamanho. Esta separação baseia-se no tamanho e massa da partícula para sedimentação. Uma utilização para este tipo de centrifugação é a separação de proteínas e anticorpos, que possuem densidades similares, porém massas diferentes. Assim, a separação com base na massa separará as diferentes classes.
Para que a centrifugação por tamanho seja bem sucedida, a densidade da solução de amostra deve ser inferior à menor densidade do gradiente; a extensão do gradiente devem ser suficiente para ocorrer a separação e o tempo deve ser bem dimensionado, pois se for muito extenso, as partículas podem ser acumular no fundo do tubo.
– Separação isopícnica. Neste caso, vamos considerar uma partícula que possui uma determinada densidade e, que será submetida ao processo de centrifugação. Após o processo, a partícula irá “estacionar” em uma posição onde a densidade da solução em que se encontra é próxima à densidade da partícula. Uma vez estabelecida a sua posição, o tempo total de centrifugação não irá alterar a migração da partícula. Uma aplicação bastante utilizada para este método é a separação de ácidos nucléicos em um gradiente de cloreto de césio (CsCl).
Para que a centrifugação seja bem sucedida, a densidade da partícula da amostra deve estar dentro dos limites das densidades de gradiente; qualquer extensão de gradiente é aceitável; o tempo de execução deve ser suficiente para que as partículas se unam em seu ponto isopícnico.
C. Ultracentrifugação
Processo de centrifugação sob pressão, permitindo a separação de partículas de modo eficiente, utilizando-se de refrigeração e vácuo de forma a minimizar o atrito com o ar, devido à elevada rotação aplicada (até 500.000g).
6. Conversão de unidades de centrifugação.
A rotação de uma centrífuga pode ser especificada em termos de Força Centrífuga Relativa (RCF) expressa em unidades de gravidade (g). Muitas centrífugas expressam a velocidade em termos de revoluções por minuto (rpm).
A conversão entre g (a força centrífuga) e rpm é dada pela relação:
onde: Fc = força centrífuga;
FCR = força centrífuga relativa;
R = diâmetro do rotor (cm)
S = velocidade da centrífuga (rpm)
M = massa da amostra
No caso do cálculo da Força centrífuga relativa, esta não considera a massa da amostra, ou a sua densidade. Quando se troca a centrífuga, deve-se recalcular o g.
7. Aplicações da centrifugação
A centrifugação pode ser utilizada além de apenas uma operação unitária na indústria. É também bastante aplicada em casos de tratamentos de fertilidade e, existem estudos que avaliam a possibilidade de separação de espermatozóides que não contenham o vírus da AIDS, para a geração de uma criança não portadora do vírus. Esta seleção realizada para humanos é utilizada em gado, com o objetivo de criar as melhores cabeças de gado, rebanho, tornando o negócio mais lucrativo.
Além da inseminação, a centrifugação, é utilizada no processo de enriquecimento de urânio. A NASA também utiliza uma espécie de centrífuga onde seus astronautas são submetidos a forças de até 20 g.
8. Referências
PESSOA JR, A. KILIKIAN, B. V., Purificação de Produtos Biotecnológicos , p. 30 a 36, Editora Manole, 2005.
http://www.lsbu.ac.uk/biology/enztech/centrifugation.html
REVISTA VEJA, 22 de setembro de 2004.
Cole-Parmer site, http://www.coleparmer.com/techinfo/techinfo.asp?htmlfile= basic-centrifugation.htm&ID=30